研究内容
(1) NMRによる薬物の膜への分配・結合のin-situ定量
投与した薬物が、細胞にどれだけ取り込まれるか、標的タンパク質にどれだけ結合するかは、薬の効果を考える際に重要です。薬物が効率的に細胞膜やタンパク質に結合すれば、投与量を抑えることができ、副作用の軽減に繋がるでしょう。創薬への展開も期待されます。ともかく、タンパク質や細胞膜への薬物の結合を正確に定量することが、重要な鍵となります。
薬物の結合量を定量する前段階として、結合した薬物とそうでないものを分離するのが一般的です。遠心分離やゲル濾過などで、両者を分離します。時には、細胞をすり潰して、結合した薬物を取り出します。ここで注意すべきは、前処理の間に、結合の状態が変わらない保証がないことです。細胞はすり潰すと"intact"でなくなり、再び別の分析にかけることはできません。そのためにも、薬物の結合量を、(前処理なしに)その場で (in situ) 正確に定量する必要があるのです。
では、どうすればよいのでしょうか。私たちは核磁気共鳴(NMR)法を使って、この課題に取り組んでいます。NMR法では生体を構成する成分を「自然」の状態で取り扱うことができます。他の分光法に比べて遷移にともなう非常に小さなエネルギー変化を観測するために、「結合した状態 (bound state)」と「遊離した状態 (free state)」を区別して定量できる可能性があるのです。
当研究室では、高分解能溶液NMR法にパルス磁場勾配法という特殊な方法を組み合わせて、脂質二分子膜への薬物の結合量と運動状態をin situで定量する方法を開発しました。(Okamura & Yoshii, J. Chem. Phys., 129, 215102 (2008))
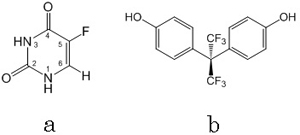
細胞膜の最も単純なモデルとして、リン脂質の一枚膜ベシクル (LUV, 直径100 nm)を用いて、抗がん剤5-フルオロウラシル(5FU、図1a)の結合量を定量しました。
その結果、5FUは約1割が膜に結合すること、5FUの膜への結合の自由エネルギーは -4~-2 kJ/molであり、これは、脂質二分子膜が熱で自然に揺らぐ程度の小さなものであることがわかってきました。薬物の膜への結合が、膜の熱揺らぎに支配されているものと考えられます。(Okamura & Yoshii, J. Chem. Phys., 129, 215102 (2008))
さらに、疎水性の強い内分泌かく乱化学物質(環境ホルモン)ビスフェノールAのフッ素置換体(FBPA、図1b)では、高濃度ベシクル溶液中で、分子のほぼすべてがベシクルに結合することがわかりました。自由エネルギー差ΔGは約20 kJ/molであり、先に求めた5FUとは対照的な結果となりました。FBPAではエントロピー駆動によって膜への結合が優位におこることも明らかとなりました。(Yoshii & Okamura, J. Phys. Chem. B, 115, 11074-11080 (2011))
(2) NMRによる膜のなかの薬物の「運動」の解析
生体膜に代表される「膜」は、ソフトで限られた空間です。このような特殊な環境のなかで、薬物はどんな振る舞いをするのでしょうか。私たちは、高分解能溶液NMR法とパルス磁場勾配法を組み合わせて、膜のなかの薬物の運動を直接捉えようとしています。
- (2-1) 膜のなかの「薬物の拡散」
図2-1は、脂質二分子膜に結合した抗がん剤5-フルオロウラシル (5FU bound)と膜に結合していない(freeの) 5-フルオロウラシル分子の運動を、同時に捉えた結果です。膜に結合した5-フルオロウラシル(5FU)が動く速さ(拡散速度)は、結合しない状態よりも2ケタ近く小さくなり、膜を形作る脂質(lipid)分子の動きと等しくなります。膜のなかの5FUの運動が膜分子の動きに支配されるためと考えられます。一方、高温になると、抗がん剤と膜分子との相互作用は弱くなり、抗がん剤分子が独立して動きまわることが明らかになりました。
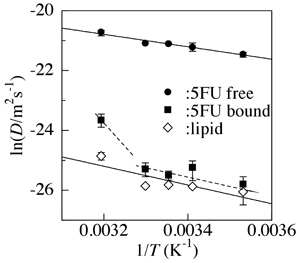
図2-1. 脂質二分子膜に結合した5FU(bound)とfreeの5FUならびに脂質分子(lipid) の動く速度の温度変化。縦軸は拡散速度の対数。上に行くほど分子の動きが速い。(Okamura & Yoshii, J. Chem. Phys., 129, 215102 (2008)より) - (2-2) 薬物の「膜への結合」と「解離」の速度論
薬物は、図2-2のように、細胞膜(membrane)に結合したり、膜から離れたりという2つの過程を絶えず繰り返しています。パルス磁場勾配NMR法を用いると、このような薬物の膜への結合と解離がどのような速さで起こっているのかを知ることもできます。
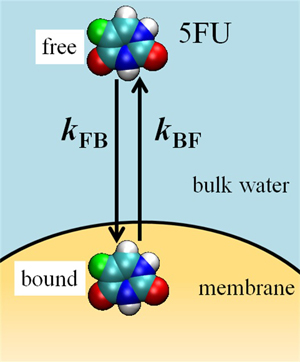
図2-2. 細胞膜への薬物の結合と解離の模式図。boundは膜に結合した薬物を、freeは解離した薬物を示す。また、kFBとkBFは、それぞれ、膜への結合と解離の速度定数である。(Yoshii & Okamura, Chem. Phys. Lett, 474, 357-361 (2009)より)
私たちは、抗がん剤5-フルオロウラシル (5FU、図1a)と内分泌かく乱化学物質(環境ホルモン)ビスフェノールAのフッ素置換体(FBPA、図1b)がどのような速さで膜に結合したり膜から離れるかを、脂質二分子膜を使って比較検討しました。その結果、5FUは、温度30 ℃では0.2 s-1という速さで膜に結合し、4.1 s-1という速さで膜から離れることがわかりました。水中の5FUの半分が、数秒間で膜に結合し、膜に結合した5FUの半分が、約0.2秒の間に膜から離れることを示しています。(Yoshii & Okamura, Chem. Phys. Lett, 474, 357-361 (2009))
一方、FBPAでは、膜への結合の速度定数が温度30 ℃で数十~数百s-1になります。FBPAは水への溶解度が極端に低く、膜が存在すると、ミリ秒の間に、その半数が水中から膜中に移行することとなり、5FUと比較すると、非常に高速であることがわかります(Yoshii & Okamura, J. Phys. Chem. B, 115, 11074-11080 (2011))
ところで、薬物は膜の表面に到達しても、すべてが膜内に取り込まれるとは限りません。膜表面にアクセスした薬物がどの程度効率的に膜のなかに取り込まれるかを明らかにすることができれば、ドラッグデザインなどに有効であると考えられます。そこで私たちは、5FUとFBPAについて、水中から膜に取り込まれる際の効率を定量化しました(図2-3)。
その結果、膜への結合確率は、FBPAの場合0.04となり、膜表面に到達したFBPA分子が約20回に1回の割合で膜に移行することが明らかになりました。一方、5FUの結合確率はFBPAの1/100,000程度の小さな値となり、膜への取り込み効率が著しく低下していることがわかりました。FBPAに比べて5FUが親水的であることが影響しているものと考えられます。(Yoshii & Okamura, J. Phys. Chem. B, 115, 11074-11080 (2011))
さらに、このような運動状態の解析は、低分子の薬物のみならず、ペプチドなど、より大きい分子についても、同じ方法で解析できることがわかってきました。(Yoshii, Emoto, and Okamura, BIOPHYSICS, 7, 105-111 (2011))
(3) In-Cell NMRによる生きた細胞への薬物輸送のリアルタイム計測
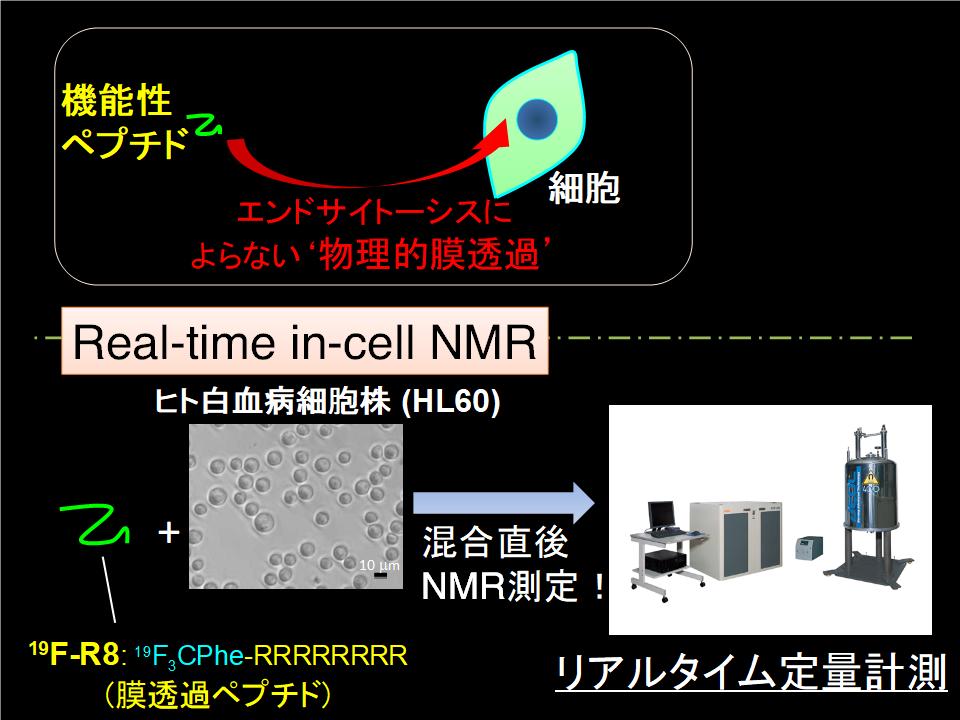
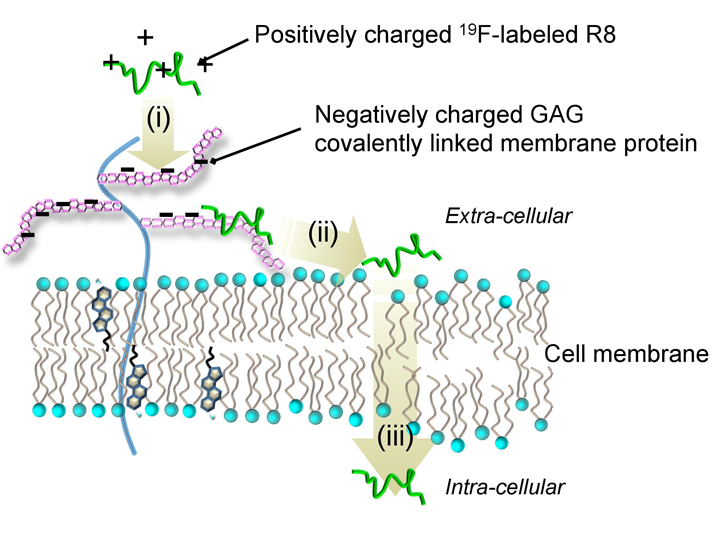
溶液NMRを細胞系に拡張し、水溶液中で「生きた」細胞への薬物輸送をリアルタイムで計測しています(図3-1)。これまでに、タンパク質や遺伝子などを細胞内へ効率的に導入する働きのあるアルギニンペプチドのヒト白血病細胞株HL60への輸送過程を分単位でリアルタイム計測し、膜輸送タンパク質が関与しない"物理的な"膜透過経路について、正電荷を有するアルギニンペプチドが(i)負に帯電した細胞表面糖鎖にトラップされた後、(ii)熱揺らぎにより疎水性の細胞膜を透過し、(iii)細胞質内に輸送されるという新しいタイプの輸送プロセスをin situで明らかにしました(図3-2)。蛍光標識を用いることなく、NMR分光法でしか得られない情報を取得する研究として、今後様々な種類のドラッグデリバリーの分子機構を解明し、新たな切り口から創薬に貢献することを目指しています。
(4) 細胞サイズベシクル中の分子の揺らぎと運動状態
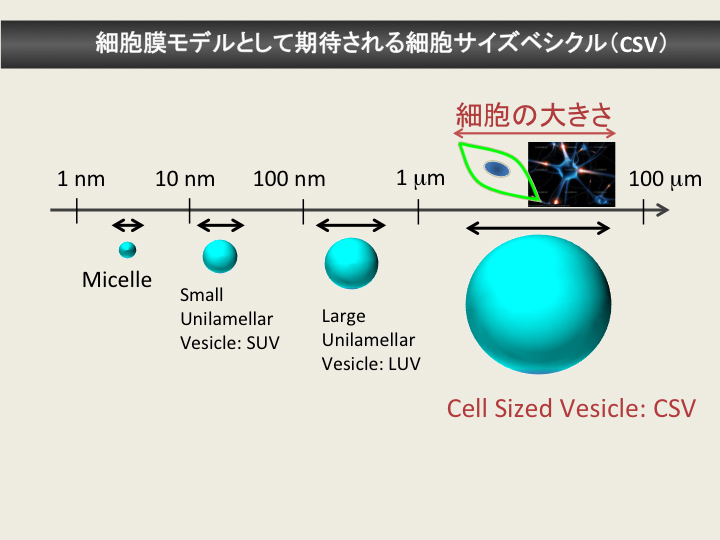
直径約10~20µmという巨大な細胞サイズベシクルCell Sized Vesicleが、より生体膜に近いモデルとして注目されています。
細胞サイズベシクルは、直径20 nm程度の一枚膜リポソーム (SUV) や直径約100 nmの一枚膜リポソーム (LUV)といった従来の膜モデルと物性が異なることが示唆されています。たとえば、(3)で紹介した「膜透過ペプチド」は、細胞サイズのベシクルは通過しますが、LUVは透過しない場合があることが知られています。しかしながら、細胞サイズのベシクルの構造や物性の詳細はまだ明らかではありません。
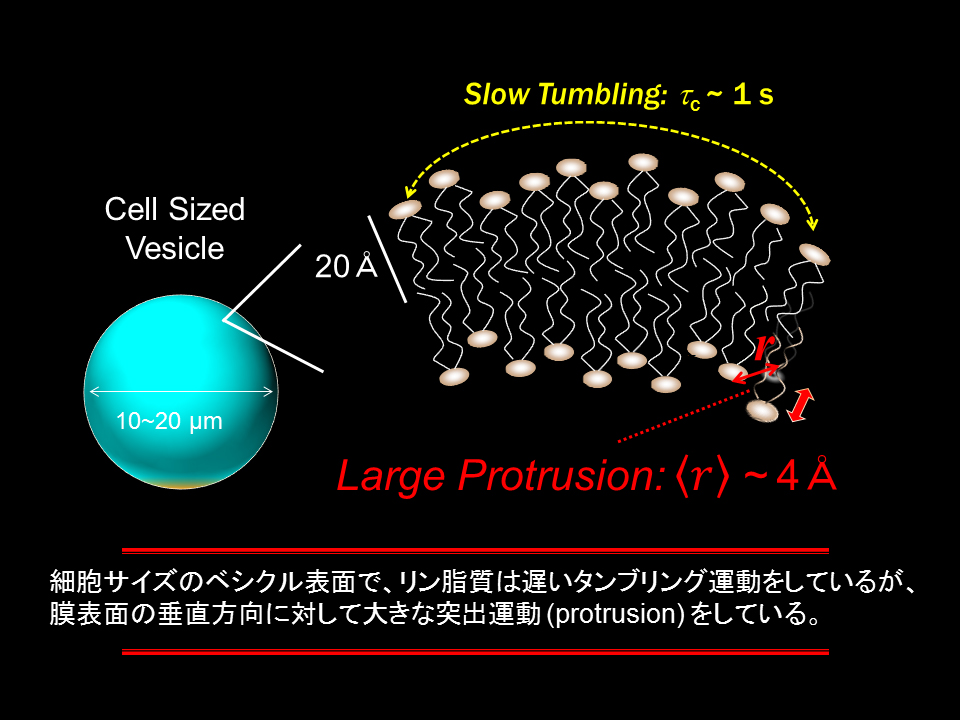
研究室では、細胞サイズのリン脂質ベシクルを高濃度で調製し、ベシクル膜中の動的な構造や分子の揺らぎ・運動状態について、溶液NMR測定で初めて解析を行いました。その結果、細胞サイズベシクルのような曲率が小さい膜中においても、リン脂質が膜面の垂直方向に大きく揺らいでいる(突出運動 protrusion) ことを見出しました(図4)。得られた知見は、膜の揺らぎと物質の透過の相関など、生体機能を理解する上で重要であると考えられます。
【参考論文】Takechi, Saito, Okamura, Chem. Phys. Lett., 570, 136-140 (2013).
(5) アミノ酸の異性化とペプチド鎖切断反応のリアルタイムNMR計測と速度論
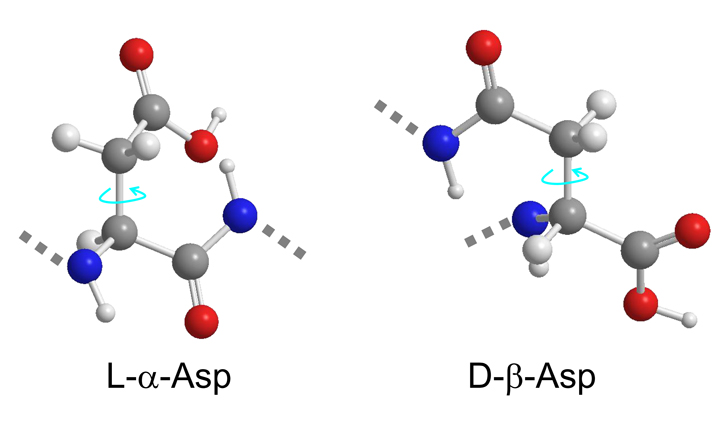
タンパク質はL-アミノ酸で構成され、D-アミノ酸は存在しないと考えられていました。ところが、高齢のヒトの水晶体タンパク質・クリスタリンの特定部位に、異性体であるD-アスパラギン酸、特に、D-β-アスパラギン酸が多く蓄積していることが分かってきました。このような、異常型のD-β-アスパラギン酸の蓄積は、タンパク質の構造や機能を変化させ、白内障など加齢による疾患の原因につながるのではないかと指摘されています。
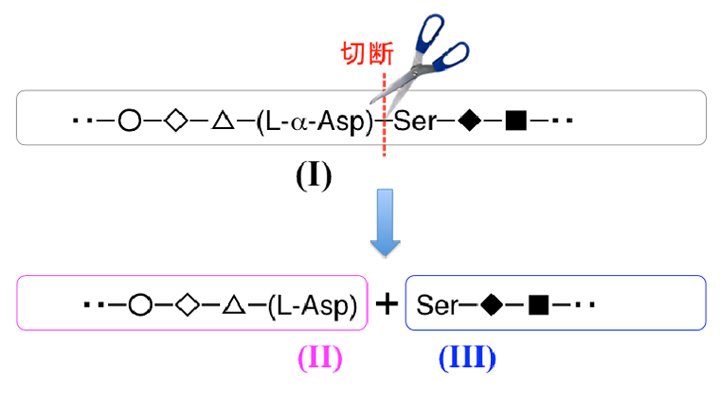
当研究室では、ペプチド中の特定のアミノ酸の異性化反応、特定のペプチド結合切断反応のプロセスをNMRでリアルタイム計測可能であることを見出しました。たとえば、水晶体タンパク質αAクリスタリン、αBクリスタリン模擬ペプチドでは、ともに、図の(I)のようにアスパラギン酸(Asp)のC側でペプチド結合が選択的に切断され(破線)、L-AspとSerを末端とする2種類の配列(II)、(III)に変化します。このようなペプチド結合の分解切断は、酵素によることなく自発的に起こる反応ですが、切断前のL-α-Asp−Serと切断によって生じた末端のL-AspとSerをNMRですべて区別し、ペプチド結合が切断される様子をリアルタイムで計測しました。天然型L-α-アスパラギン酸(L-α-Asp)がD-β-アスパラギン酸(D-β-Asp)に異性化するとペプチド結合の切断が抑制されることを、速度論解析によってはじめて明らかにしました。D-β-Aspの反応性が極端に低いことが、結果的に異常なD-β-Aspの蓄積につながるものと考えられます。
【参考論文】Aki & Okamura, Scientific Reports, 6, 21594 (2016).
