食細胞による生体防御機構の解明
マクロファージと好中球の多彩な機能に迫る!
はじめに:食細胞とは
食細胞は血液細胞(赤血球、白血球、血小板から成る)の中の白血球という一群に属します。白血球は多種類の細胞で構成されており、協力して生体防御の役割を担います。その中にあって食細胞、とりわけマクロファージと好中球は、私達の体の中を移動し、病原微生物や異物を取り込んで、あたかも単細胞生物のように振る舞い、細胞生物学的にも興味深い細胞です。
私たちの研究目標
私たちの研究室では、食細胞、とりわけマクロファージと好中球に注目して研究に取り組んでいます。食細胞は様々なストラテジーで私達の体を守っていますが、その強力な分解能故に過剰に活性化すると重篤な病態を招きます。食細胞の活性化と制御のしくみを分子レベルで明らかにし、感染症や自己免疫疾患の新規な治療法の基盤となる研究をめざしています。
研究テーマの紹介
(1) 補体を介した食作用について
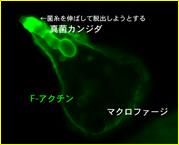 好中球やマクロファージによる食作用は、病原微生物の殺菌、炎症や獲得免疫の誘導など、生体防御に重要な役割を果たしています。私達は補体を介した食作用に注目して研究をおこなってきました。その成果として、1)チロシンキナーゼSykが補体受容体を介した食胞の細胞内への取り込みに必須の役割を果たしていること(Blood. 2006;107(11):4554-62.)や、2)血球貪食症候群*の原因遺伝子である低分子量Gタンパク質Rab27aが、食胞形成に必須のF-アクチンの崩壊を遅らせることにより食作用を負に制御していることを報告しました(J Biol Chem. 2011;286(7):5375-82.)。
好中球やマクロファージによる食作用は、病原微生物の殺菌、炎症や獲得免疫の誘導など、生体防御に重要な役割を果たしています。私達は補体を介した食作用に注目して研究をおこなってきました。その成果として、1)チロシンキナーゼSykが補体受容体を介した食胞の細胞内への取り込みに必須の役割を果たしていること(Blood. 2006;107(11):4554-62.)や、2)血球貪食症候群*の原因遺伝子である低分子量Gタンパク質Rab27aが、食胞形成に必須のF-アクチンの崩壊を遅らせることにより食作用を負に制御していることを報告しました(J Biol Chem. 2011;286(7):5375-82.)。
さらに研究を進めて、生きた微生物に対してマクロファージがどのように対応するのか、日和見感染の原因となる真菌カンジダとの攻防をモデルとし、貪食された真菌カンジダの脱出を阻止する分子メカニズムについて検討しています(上図)。
*血球貪食症候群はマクロファージの強力な処理機構が私たちの生命を脅かす疾患。マクロファージが患者自身の血液細胞、赤血球、血小板、時には好中球でさえ貪食するがその原因に関わる分子作用機序は未解明
(2) 巨大なマクロファージ,破骨細胞による骨分解機構の解析
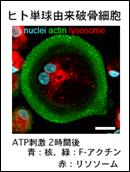 破骨細胞は骨を分解する巨大なマクロファージです。破骨細胞による過剰な骨分解は骨粗鬆症や関節リウマチなど重篤な疾患の原因となります。骨破壊性疾患の分子機序を明らかにするため、破骨細胞に骨分解を誘導するシグナルを探索しました。その結果、ATPが破骨細胞表面の核酸受容体P2X7 を介して、骨分解開始因子として働き、アクチン細胞骨格の再構成と微小管のアセチル化、さらに骨分解顆粒の輸送を惹起して,最終的に骨分解酵素が骨表面に放出されることを見いだしました(Genes Cells. 2009; 14: 871-84.)。
破骨細胞は骨を分解する巨大なマクロファージです。破骨細胞による過剰な骨分解は骨粗鬆症や関節リウマチなど重篤な疾患の原因となります。骨破壊性疾患の分子機序を明らかにするため、破骨細胞に骨分解を誘導するシグナルを探索しました。その結果、ATPが破骨細胞表面の核酸受容体P2X7 を介して、骨分解開始因子として働き、アクチン細胞骨格の再構成と微小管のアセチル化、さらに骨分解顆粒の輸送を惹起して,最終的に骨分解酵素が骨表面に放出されることを見いだしました(Genes Cells. 2009; 14: 871-84.)。
(3) 好中球によるNETs形成機構の解明
 好中球が投網のごとく変形して微生物を包み込むNeutrophil Extracellular Traps(NETs)形成機構の解明に取り組んでいます。NETsの網本体は繊維状にほどけた核酸DNAです。核の中でコンパクトに折りたたまれていたクロマチン(DNA-ヒストン複合体)が脱凝縮し、核膜が消失して抗菌顆粒が繋ぎ止められ、最後に細胞膜が崩壊して、放出されたNETsが微生物をトラップすることで感染の拡大を防御します。生体において、NETsは速やかに分解されますが、何らかの異常でNETsの分解が不十分な時、自己抗体の産生を誘導して、SLEやANCA血管炎など
好中球が投網のごとく変形して微生物を包み込むNeutrophil Extracellular Traps(NETs)形成機構の解明に取り組んでいます。NETsの網本体は繊維状にほどけた核酸DNAです。核の中でコンパクトに折りたたまれていたクロマチン(DNA-ヒストン複合体)が脱凝縮し、核膜が消失して抗菌顆粒が繋ぎ止められ、最後に細胞膜が崩壊して、放出されたNETsが微生物をトラップすることで感染の拡大を防御します。生体において、NETsは速やかに分解されますが、何らかの異常でNETsの分解が不十分な時、自己抗体の産生を誘導して、SLEやANCA血管炎など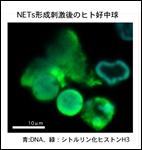 の自己免疫疾患の原因となります。私達の研究室では、NETs形成から崩壊までのプロセスを可視的、生化学的に追跡し、分子機序として紐解く研究に取り組んでいます。その成果として、Rab27aがNADPH Oxidaseの活性化に関与してNETs形成に重要な役割を果たしていることを示しました(PLoS One. 2014 9(1):e84704.)。
の自己免疫疾患の原因となります。私達の研究室では、NETs形成から崩壊までのプロセスを可視的、生化学的に追跡し、分子機序として紐解く研究に取り組んでいます。その成果として、Rab27aがNADPH Oxidaseの活性化に関与してNETs形成に重要な役割を果たしていることを示しました(PLoS One. 2014 9(1):e84704.)。

 HOME
HOME